Минздрав усложняет процедуру выхода лекарств на российский рынок
Выход лекарств на российский рынок может осложниться. Минздрав хочет выдавать разрешения на проведение клинических исследований новых лекарств после проверки качества образцов препаратов. Для инновационных это невозможно
Производителям лекарств, чтобы получить разрешение на проведение клинических исследований, придется проводить фармацевтическую экспертизу образцов лекарств, говорится в разработанных Минздравом поправках в закон «Об обращении лекарств». Документ опубликован на сайте министерства.
Фармацевтическая экспертиза – это проверка качества образцов уже готового лекарства, объясняет исполнительный директор Ассоциации организаций клинических исследований (АОКИ) Светлана Завидова. Сейчас фармацевтическая экспертиза образцов проводится в момент регистрации, т.е. после окончания клинических исследований, уточняет она.
Но для инновационных препаратов на предлагаемом Минздравом этапе фармэкспертизу провести невозможно, продолжает Завидова: для оригинальных препаратов критерием качества является соответствие нормативной документации для конкретного препарата. Эта документация и методы контроля качества утверждаются на этапе регистрации лекарства, т.е. после завершения клинических исследований, говорит Завидова.
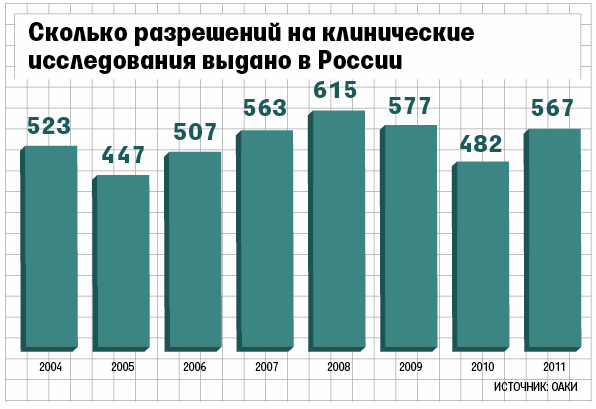
Предлагаемая Минздравом процедура теоретически возможна для дженериков (т.е. аналогов оригинальных препаратов) и уже зарегистрированных оригинальных лекарств, если проводятся исследования по новым показаниям, поясняет Завидова. Для дженериков качество лекарства означает его соответствие требованиям фармакопейной статьи (документ, содержащий перечень показателей качества и методов контроля качества лекарства, принимается для каждого международного непатентованного наименования. – «Ведомости»). Но тогда увеличатся сроки получения разрешений на проведение клинических исследований, предупреждает Завидова. Сейчас средний срок получения разрешений, по данным АОКИ, – 118 дней. Фармэкспертиза образцов занимает около полугода.
Введение этой нормы ставит под сомнение возможность участия России в международных многоцентровых исследованиях, считает гендиректор компании Amgen в России Виктория Анашкина. Сроки получения разрешений на проведение исследований – один из основных факторов, которые учитывают спонсоры при их размещении в той или иной стране, говорит Завидова: набор пациентов во многих исследованиях конкурентный, как только набрано необходимое количество участников, дальнейший набор во всех странах прекращается. Россия требует обязательного проведения локальных исследований для тех препаратов, при испытании которых страна не была включена в международные многоцентровые исследования, напоминает эксперт. Таким образом, новое требование может «самым негативным образом отразиться» на возможности регистрации в стране зарубежных инновационных препаратов, резюмирует Анашкина.
«Надеемся, что в результате обсуждения законопроекта будут выработаны оптимальные решения, способствующие формированию более эффективной регуляторной системы и дальнейшему созданию привлекательных условий для российских и международных инвестиций в фармацевтическую отрасль России», – заключает Анашкина.
Запрос в Минздрав остался без ответа.