Копируйте копии
Минздрав, выдавая разрешения на проведение клинических исследований, разрешал сравнивать дженерики с другими дженериками, а не с оригинальными лекарствами. Теперь министерство хочет узаконить такую практикуСреди дженериков, которые министерство разрешило сравнивать с другим дженериком, а не с оригинальным препаратом, лекарства для лечения ВИЧ, онкологических и кардиологических заболеваний, указывает АОКИ. Так, компании «Атолл» и «ЗиО-здоровье» получили разрешение на проведение исследования биоэквивалентности препаратов с международным непатентованным наименованием (МНН, т. е. действующее вещество) валсартан + гидрохлоротиазид (применяется для лечения артериальной гипертензии). Свои лекарства они сравнивают с препаратом словенской KRKA, указано в реестре выданных разрешений на проведение клинических исследований. Но оригинальный препарат производит швейцарская Novartis, указывает АОКИ. С препаратом этой компании сравнивают свои лекарства компании Polpharma и Zentiva. Подмосковная «Технология лекарств» и иркутский «Фармасинтез», по данным реестра, сравнивают препараты для лечения ВИЧ с МНН тенофовир с препаратом индийской Hetero Drugs Ltd (дженерик), а «Биокад» — с оригинальным лекарством производства Gilead Sciences. Подмосковный «Ф-синтез» в качестве препарата сравнения для своего противоопухолевого лекарства с МНН гидроксикарбамид использует препарат польской Pliva, а «Лэнс-фарм» — оригинальный препарат Bristol-Myers Squibb.
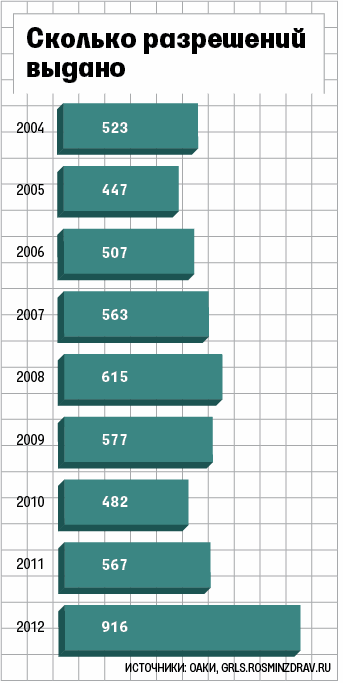
Минздрав в 2012 г. одобрил несколько исследований биоэквивалентности (их проводят для регистрации дженериков, т. е. аналогов оригинальных лекарств), где в качестве препарата сравнения используется не оригинальный препарат, а его аналог — т. е. дженерик, обнаружила Ассоциация организаций по клиническим исследованиями (АОКИ). Дженерики регистрируются по упрощенной схеме: вместо полных клинических испытаний требуются только исследования биоэквивалентности, которые подтверждают, что воспроизведенный препарат в определенной лекарственной форме и дозировке соответствует оригинальному.
Регистрация дженериков на основании сравнения с другими дженериками противоречит закону «Об обращении лекарств», пишет АОКИ. По закону оригинальные лекарства — это те, которые содержат впервые полученную фармацевтическую субстанцию, для их регистрации требуется провести доклинические и полноценные клинические исследования, говорит директор по правовым и регуляторным вопросам ассоциации «Фармацевтические инновации» Нина Белозерцева.
Минздрав предлагает законодательно разрешить сравнивать дженерик в исследованиях биоэквивалентности не только с оригинальным препаратом, но и с другими «препаратами сравнения». Об этом говорится в поправках к закону «Об обращении лекарств» (есть на сайте министерства).
При исследованиях биоэквивалентности допустимым считается отклонение основных показателей дженерика от оригинального препарата на 15-20%, указывает АОКИ. Но если использовать в качестве препаратов сравнения дженерики, то с каждой последующей копией разница в показателях с оригиналом будет все больше. Для исследований биоэквивалентности требуется гораздо меньше пациентов, чем для полноценных клинических исследований, говорит Белозерцева, если дженерики будут сравниваться с дженериками, есть риск, что качество препаратов будет ухудшаться. Исследование биоэквивалентности занимает около трех месяцев, для него нужно не менее 18 пациентов, а полноценное клиническое исследование — около года, в нем участвует минимум 60 пациентов, разница в цене таких исследований — минимум 10 раз, говорит гендиректор DSM Group Сергей Шуляк.
Запросы, отправленные в «Технологию лекарств» и «ЗиО-здоровье», остались без ответа. Представитель Минздрава от комментариев отказался. С компаниями «Атолл», «Фармасинтез» и «Ф-синтез» связаться не удалось.
Исправленная версия. Первоначальный опубликованный вариант можно посмотреть в архиве "Ведомостей" (Смарт-версия).